以大黄素为代表的蒽醌类化合物是一类广泛存在于植物和丝状真菌中的重要天然产物,因其多样的生物学活性,如消炎、抗病毒、抗肿瘤、抗氧化、泻下等,而备受广泛关注。蒽醌化合物C10-C4a键的切割是导致开环产生的裂醌化合物结构多样性的关键。尽管裂醌化合物的生物合成途径已基本清晰,但其中最为关键的蒽醌开环机制却仍存在疑团。
日前,中国科学院青岛生物能源与过程研究所(青岛能源所)微生物制造工程中心研究人员针对土曲霉地曲霉素生物合成基因簇中关键基因GedF和GedK展开了研究,发现了一类双酶催化的蒽醌双加氧开环新机制,相关成果已以“Bienzyme-catalytic and dioxygenation-mediated anthraquinone ring opening”为题,在线发表于最新出版的化学领域权威期刊《美国化学会志》(J. Am. Chem. Soc.)上。
大黄素-8-甲醚是一种蒽醌类化合物,也是土曲霉地曲霉素生物合成途径中的关键中间体。基于前期同位素追踪实验和日本学者Sankawa等的研究结果,长期以来科学界一直倾向于大黄素-8-甲醚的Baeyer-Villiger氧化开环假说。基于该假说,一个Baeyer-Villiger氧化酶催化大黄素-8-甲醚生成具有七元环结构的中间体,进而水解开环形成开环产物desmethylsulochrin。但是,本工作中研究人员通过一系列体内敲除和体外酶活表征研究发现,GedF和GedK两个酶共同催化了大黄素-8-甲醚的开环过程,其中GedF首先催化还原大黄素-8-甲醚产生大黄素-8-甲醚氢醌,进而大黄素-8-甲醚氢醌在GedK的作用下开环产生desmethylsulochrin(图1)。
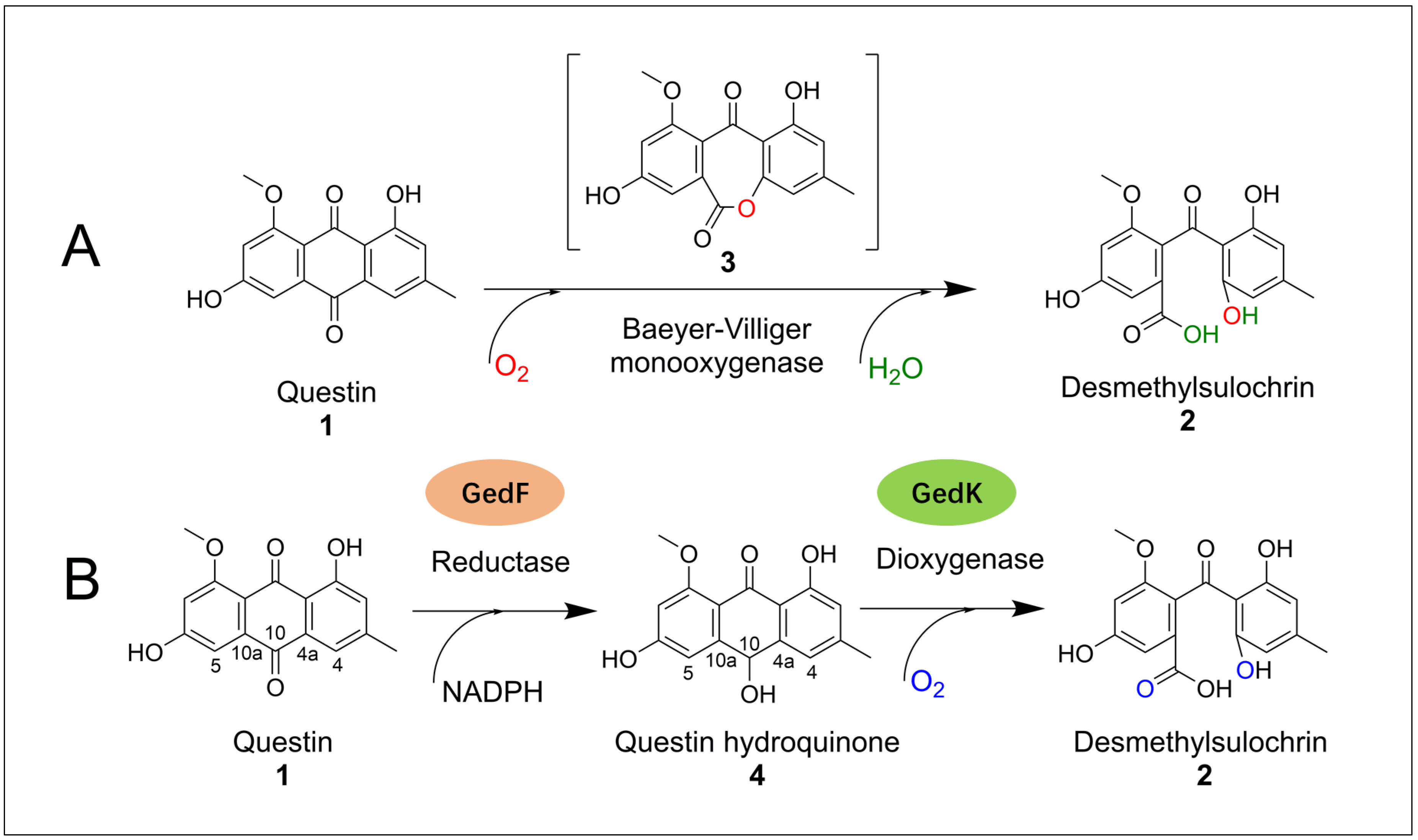
图1. 土曲霉大黄素-8-甲醚开环机制
(A)传统的大黄素-8-甲醚开环机制假说;(B)修正的大黄素-8-甲醚开环机制假说。
进一步18O同位素追踪实验显示,开环产物desmethylsulochrin中新增的两个氧原子均来源于同一个O2分子,且GedK执行催化开环功能并不需要辅因子FAD和NADPH的参与,这说明GedK是一类独特的不需要辅因子参与的双加氧酶。上述发现彻底推翻了传统的蒽醌化合物Baeyer-Villiger氧化开环假说,并提出了一种双酶催化双加氧反应介导的蒽醌开环新机制。
有意思的是,还原酶GedF和双加氧酶GedK双酶开环系统具有较广的底物宽泛性,可催化多种蒽醌类化合物开环,且其同源蛋白在自然界裂醌化合物生物合成基因簇中成对出现并存在共进化关系。本研究的开展不仅为阐明更加复杂的裂醌化合物生物合成机制提供了借鉴,更为合成生物学元件库提供了两种全新的酶学元件。
中心主任吕雪峰研究员为本论文的通讯作者,副研究员齐飞飞为论文的第一作者。本研究获得了国家自然科学基金、山东省泰山学者计划和国家重点研发计划的支持。
文章链接:https://doi.org/10.1021/jacs.1c07182
图/文:齐飞飞